TAMBANGILMU.COM - Semua benda logam disekitar kita, terutama besi pasti akan rusak jika dibiarkan begitu saja. Logam tersebut akan berubah warna menjadi coklat dan semakin lama akan semakin rapuh. Pada kesempatan kali ini admin tambangilmu akan membahas tentang pengertian korosi, keuntungan, kerugian serta bagaimana korosi itu dapat terjadi dan cara pencegahan korosi yang akan dijelaskan secara lengkap dan mudah untuk dimengerti.
PENGERTIAN KOROSI
Korosi adalah perusakan suatu bahan (terutama logam) karena bereaksi dengan linkungan, sehingga sebagian logam akan hilang menjadi suatu senyawa yang lebih stabil. Jadi korosi juga dikatakan sebagai peristiwa kembalinya logam menuju bentuknya sebagaimana terdapat di alam.
- Penampilan kurang baik,
- Kebocoran / kelonggaran,
- Kerusakan konstruksi,
- Penghentian proses produksi,
- Biaya perawatan,
- Pencemaran (mis. makanan, minuman).
Keuntungan Korosi:
- Proses etsa (etching) yang digunakan untuk menghasilkan reaksi kimia pada mikrostruktur suatu logam sehingga dapat dilihat batas butirnya.
- Arus listrik yang dihasilkan pada baterai kering merupakan hasil dari proses korosi.
Jenis Korosi:
- Korosi kimia (chemical corrosion), yaitu korosi yang terjadi dengan reaksi kimia secara murni. Biasanya terjadi pada temperatur tinggi atau dalam keadaan kering. contoh: katup motor bakar
- Korosi elektrokimia (electrochemical corrosion), yaitu korosi yang terjadi bila reaksinya berlangsung dengan suatu elektrolit, yaitu cairan yang mengandung ion-ion. Reaksi berlangsung dengan adanya air/uap air. Reaksi semacam inilah yang paling banyak terjadi pada reaksi korosi.
1. Reaksi Oksidasi / Anodik
Bila sepotong logam dicelupkan ke dalam larutan elektrolit maka beberapa atom logam akan larut ke dalam elektrolit dengan melepaskan sejumlah elektronnya ke logam mengalami oksidasi
Contoh logam yang mengalami oksidasi :
Bagian yang mengalami oksidasi disebut anode, kadamg-kadang oksidasi disebut reaksi anodik.
2. Reaksi Reduksi / Katodik :
Elektron yang dihasilkan dari atom logam yang mengalami oksidasi harus ditransfer dan menjadi bagian dari unsur kimia yang lain yang disebut dengan istilah reaksi reduksi. Contoh: beberapa logam yang mengalami korosi pada larutan asam, yang memiliki konsentrasi tinggi ion hydrogen (H⁺); ion H⁺ berkurang sebagai berikut:
Ion logam yang berada dalam larutan dapat juga berkurang menjadi logam netral:
Posisi tempat terjadinya pengurangan / reduksi ion disebut Katode.
Reaksi Oksidasi dan Reaksi Reduksi
Keseluruhan reaksi elektrokimia minimal harus terdiri dari satu reaksi oksidasi dan satu reaksi reduksi, Contoh: Logam seng (Zn) dicelupkan dalam larutan asam yang berisi ion H⁺
:
Karena seng adalah logam, maka memiliki daya hantar listrik yang baik, sehingga elektron akan mudah bergerak menuju ion H⁺
membentuk gas H₂ :
Bila tidak ada reaksi oksidasi dan reaksi reduksi yang lain, nmaka total reaksi elektrokimia adalah penjumlahan dari kedua reaksi tersebut.
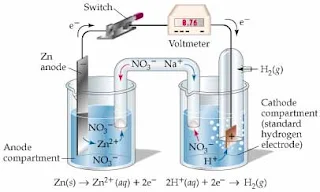
Mengukur Besarnya Elektrode Potensial
Mengukur besarnya elektrode potensial dari suatu elektrode (logam) tidaklah mungkin, maka untuk mengukur besarnya elektrode potensial suatu logam dilakukan pengukuran besarnya beda potensial antara logam itu dengan suatu elektrode standar, biasanya hidrogen, dalam suatu elektrolit tertentu.
1. Composition Cell
2. Concentration Cell
Mengukur besarnya elektrode potensial dari suatu elektrode (logam) tidaklah mungkin, maka untuk mengukur besarnya elektrode potensial suatu logam dilakukan pengukuran besarnya beda potensial antara logam itu dengan suatu elektrode standar, biasanya hidrogen, dalam suatu elektrolit tertentu.
Dalam hal ini platina (pt) tidak mengalami reaksi elektrokimia, hanya sebagai permukaan dimana atom hidrogen beroksidasi atau ion hidrogen bereduksi.
Standar Elektrode Potensial
Galvanic Cell
Suatu reaksi korosi dapat berlangsung bila ada bagian yang berfungsi sebagai anode (yang terkorosi) dan ada bagian lain yang berfungsi sebagai katode, yang berhubungan satu sama lain, dinamakan Galvanic Cell. Galvanic Cell ini terjadi karena perbedaan potensial antara kedua bagian itu. Ada 3 jenis Galvanic Cell :
Composition Cell dapat terjadi antara 2 logam yang berbeda.
Logam dengan elektrode potensial yang lebih positif (lebih mulia) akan menjadi katode dan yang lebih negatif menjadi anode.
Perbedaan potensial juga dapat terjadi dalam satu logam/paduan, karena:
- Adanya impuritas pada mikrostruktur, yang biasanya terkumpul pada batas butir kristal.
- Adanya perbedaan orientasi butir kristal
- Adanya perbedaan komposisi dalam suatu butiran kristal
- Adanya lebih dari satu fase
2. Concentration Cell
Concentration Cell yaitu sel galvanic yang terjadi karena salah satu bagian logam berada dalam suatu elektrolit dengan konsentrasi yang berbeda, misalnya karena larutan elektrolit yang tidak homogen, atau adanya konsentrasi oksigen terlarut yang lebih tinggi dipermukaan, atau adanya kotoran dipermukaan logam yang menyerap air, dll.
3. Stress Cell
Stress Cell terjadi karena adanya bagian yang mengalami tegangan yang berbeda dengan yang lain, misalnya sebagai akibat deformasi dingin, atau karena perlakuan panas. Bagian yang mengalami tegangan yang lebih besar akan menjadi anode, dan akan terkorosi lebih hebat.
Klarifikasi Korosi Berdasarkan Bentuknya
- Uniform Corrosion yaitu korosi yang terjadi pada seluruh permukaan logam / paduan yang bersentuhan dengan elektrolit, dengan intensitas sama.
- Galvanic Cell terjadi bila dua logam yang berbeda beda dalam satu elektrolit.
- Crevice Corrosion terjadi pada celah-celah yang sempit.
- Pitting Corrosion merupakan korosi yang terlokalisir pada satu atau beberapa titik dan mengakibatkan terjadinya lubang kecil yang dalam (berbahaya)
- Intergranular Corrosion yaitu korosi yang tejadi pada batas butir
- Erosion Corrosion yaitu korosi yang dipercepat oleh adanya erosi yang ditimbulkan oleh gerakan cairan
- Stress Corrosion yaitu korosi yang timbul sebagai akibat bekerjanya tegangan dan media yang terkorosit.
Faktor yang Mempengaruhi Korosi:
- Jenis dan konsentrasi elektrolit
- Adanya oksigen terlarut pada elektrolit
- Temperatur tinggi
- Kecepatan gerakan elektrolit (Note : pitting dan crevice corrosion terjadi pada elektrolit yang tidak mengalir)
- Jenis logam/paduan
- Adanya Galvanic Cell
- Adanya tegangan(tarik)
Pencegahan Korosi:
- Pemilihan bahan yang tepat
- Merubah kondisi lingkungan
- Desain yang tepat
- Catodic protection
- Anodic protection
- Surface Coating
Pemilihan Bahan yang Tepat
Suatu elektrolit mempunyai pengaruh yang berbeda terhadap bahan yang berbeda, dengan kata lain bahan tertentu akan tahan korosi terhadap suatu elektrolit tertentu. Contoh kombinasi logam/paduan - elektrolt korosif yang memiliki sifat tahan korosi yang tinggi terhadap elektrolit itu:
- Stainless steel - nitrid acid;
- Nickel/nickel alloy - caustic;
- Monel - hydrofluoric acid;
- Lead - dilute sulfuric acid;
- Aluminium - nonstaining atmospheric exposure;
- Steel - concentrated sulfuric acid.
Mengubah Kondisi Lingkungan
Ada beberapa hal yang dapat dilakukan untuk menurunkan tingkat korosi:
- Menurunkan Temperatur
- Menurunkan kecepatan aliran elektrolit
- menghilangkan oksigen/oksidiser terlarut
- menurunkan konsentrasi
Desain yang Tepat
Ada beberapa hal yang perlu diperhatikan dalam mendesain suatu produk, antara lain:
- Hindari adanya celah-celah sempit
- Hindari adanya kantong-kantong yang memungkinkan adanya sisa cairan
- Bagian-bagian yang mudah rusak harus mudah penggantiannya
- Hindari adanya bagian yang mengalami tegangan yang besar
- Pada kontruksi pipa, hindari adanya belokan yang terlalu tajam
- Hindari adanya kantong-kantong udara pada saluran/tangki
Cathodic Protection
Pada reaksi korosi di anode akan terjadi reaksi yang menghasilkan elektron dan bila elektron ini dialirkan keluar dari anode ke katode, maka reaksi korosi akan berlanjut. Untuk menghindarkan hal tersebut dapat dilakukan dengan mensupplay arus listrik dari luar atau dengan sacrifical anode (galvanic coupling) dengan logam yang kurang mulia dibandingkan dengan logam yang akan dilindungi.
Anodic Protection
Merupakan kebalikan dari cathodic protection, arus listrik hasil dari korosi bukan dilawan tetapi justru diperbesar, sehingga kekuatan arus itu mencapai daerah pasif, reaksi terhenti. Proteksi semacam ini hanya dapat digunakan untuk logam/paduan yang memiliki passivity, misalnya baja.
Terdapat 3 Jenis Pelapisan (coating), yaitu:
- Metallic Coating, yaitu melapisi dengan logam yang kurang mulia dibandingkan dengan logam yang dilindungi, contoh baja dilapisi dengan seng
- Oxyde Coating, yaitu melapisi dengan oksida (secara alamiah terjadi pada aluminum). Juga dapat dibuat yaitu dengan mencelupkan logam yang akan dilindungi ke dalam oxydizing agent yang kuat (chromate atau carbonate yang dipanaskan), atau dengan anodizing
- Organic Coating, yaitu pelapisan dengan senyawa organik, misalnya pengecatan.
Demikian penjelasan tentang Teori Dasar Korosi dan Cara Pencegahannya Lengkap. Semoga artikel di atas bermanfaat.
Baca juga
- Pengertian Zat dan Perubahan Wujudnya Beserta Rumus Lengkap
- Pengertian Zat dan Pembagiannya Berdasarkan Kemurnian Lengkap
- Pengertian Ion dan Contohnya Lengkap
- Pengertian Molekul dan Contohnya Lengkap
- 11 Manfaat Zat Aditif Pada Makanan dan Minuman Beserta Contohnya Lengkap
- Pengertian Atom dan Sejarahnya Lengkap