Termodinamika berkaitan erat dengan fisika energi, kerja, panas, entropi, dan spontanitas proses.
Selain itu, termodinamika juga melibatkan mekanika statik. Selanjutnya cabang ilmu fisika ini mempelajari pertukaran energi berupa panas dan kerja, sistem pembatas dan lingkungan.
Kemudian penerapan dan penerapan termodinamika akan terjadi dalam tubuh manusia, seperti pada peristiwa atau peristiwa yang terjadi di kopi panas, lemari es, peralatan elektronik, mobil, pembangkit listrik, dan industri.Ini adalah peristiwa termodinamika yang paling umum ditemui setiap hari.
Oleh karena itu, pada kali ini admin tambangilmu akan membagikan Termodinamikas : Pengertian, Konsep dan Rumus yang bisa kalian pahami.
Prinsip Termodinamika
Gambar ini menunjukkan penerapan prinsip termodinamika, termasuk mekanika, kalor, dan kalkulus diferensial.
Gambar di bawah ini menunjukkan bahwa penyelesaian termodinamika suatu masalah diselesaikan dalam beberapa tahap, antara lain:
Menguraikan masalah menjadi bentuk kuantitatif dan termodinamika. Kemudian ubah bahasa dalam soal menjadi bahasa termodinamika, lalu gunakan besaran termodinamika untuk menyatakannya.
- Baca Juga : Perbedaan Sel Hewan dan Sel Tumbuhan Lengkap
Masalah termodinamika terpecahkan. Pada tahap ini, diperlukan dukungan pengetahuan matematika / kalkulus (diferensiasi, integrasi) untuk mendapatkan jawaban yang efektif atau bertanggung jawab.
Tiga langkah penyelesaian termodinamika harus didasarkan pada argumen atau aturan termodinamika.
Intinya, prinsip termodinamika ini sebenarnya merupakan fenomena alam yang terjadi dalam kehidupan sehari-hari.
Dengan berkembangnya ilmu pengetahuan dan teknologi, desain termodinamika telah menjadi suatu mekanisme yang dapat membantu aktivitas manusia.
Sejak abad ke-17, perkembangan termodinamika telah memungkinkan penerapan termodinamika secara luas, dan kemudian perkembangan termodinamika dimulai dengan metode makroskopis, yaitu perilaku umum partikel materi, yang kemudian menjadi pembawa energi.
Proses Termodinamika
Menurut keadaan tekanan, volume dan suhu selama proses berlangsung, proses termodinamika dibagi menjadi empat jenis. Proses ini biasanya diwakili oleh grafik P-V, yang menggambarkan tekanan (P) dan volume (V) di mana proses tersebut terjadi.
Dalam berbagai proses termodinamika, dua hal penting yang harus diperhatikan, yaitu variabel yang diubah dan pekerjaan yang dilakukan. Dengan menghitung luas pada diagram P-V, Anda dapat mengetahui atau mengetahui pekerjaan yang terjadi pada proses termodinamika.
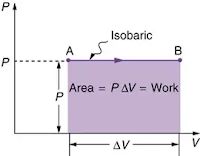
Proses Isobarik
Isobarik adalah proses termodinamika dan tidak mengubah nilai tekanan sistem isobarik. Nilai bisnis bisa atau bisa dihitung dengan rumus berikut ini.
Proses Isokhorik
Isochron adalah proses termodinamika dan tidak mengubah nilai volume dari sistem isochron. Dalam proses ini, karena tidak ada area bentuk pada citra P-V, nilai layanannya adalah 0.
Proses Isotermik
Ini adalah proses termodinamika dan tidak akan mengubah suhu sistem.
Nilai bisnis yang diproses secara isotermal dinyatakan dengan persamaan berikut:
Di mana n adalah jumlah zat yang dinyatakan dalam satuan mol, R adalah konstanta gas, dan T adalah suhunya. Rumus ini dapat diperoleh dengan menggabungkan persamaan bisnis pada diagram P-V dengan persamaan gas ideal.
Proses Adibatik
Adiabatic adalah proses termodinamika dan tidak mengubah nilai kalor sistem (Q = 0).
Pada gas monoatomik ini, usaha yang dilakukan oleh proses adiabatik dapat atau dapat dinyatakan dengan persamaan berikut:
Sekilas proses adiabatik dan isotermal ini memiliki diagram P-V yang serupa. Secara detail dapat atau dapat dilihat bahwa slope proses adiabatik lebih besar dari slope proses isotermal, seperti yang ditunjukkan pada contoh grafik berikut.
Jika keseluruhan proses digambarkan sebagai diagram P-V, diagram berikut dapat diperoleh. Perlu diingat bahwa satuan yang digunakan dalam perhitungan adalah satuan internasional. Misalnya, satuan suhu adalah Kelvin, satuan volume adalah m3, dan satuan massa adalah mol.
Sistem Termodinamika
Sistem termodinamika ini adalah bagian dari alam semesta komputasi. Batas nyata atau yang dapat dibayangkan memisahkan sistem dari alam semesta, dan inilah lingkungannya.
Berdasarkan sifat dari batas sistem-lingkungan dan perpindahan materi, panas dan entropi antara sistem dan lingkungan, sistem termodinamika diklasifikasikan.
Menurut jenis pertukaran yang terjadi antara sistem dan lingkungan, sistem dibedakan menjadi tiga jenis:
Sistem tertutup
Ada pertukaran energi (panas dan kerja), tetapi tidak ada pertukaran benda dengan lingkungan. Rumah kaca adalah contoh sistem tertutup yang bertukar panas tetapi tidak bertukar panas dengan lingkungan. Apakah sistem pertukaran panas, pertukaran panas, atau keduanya umumnya dianggap sebagai atribut pembatas:
- Penghalang isolasi: tidak memungkinkan pertukaran panas
- Hambatan yang ketat: komunikasi kerja tidak diperbolehkan.
Sistem terisolasi
Tidak ada pertukaran panas antara panas, benda atau lingkungan. Contoh sistem isolasi adalah wadah berinsulasi, seperti tabung gas berinsulasi.
Sistem terbuka
Terjadi pertukaran energi (panas serta kerja) dan juga benda dengan lingkungannya. Sebuah pembatas tersebut kemudian memperbolehkan pertukaran benda disebut dengan sebutan permeabel. Samudra ini merupakan contoh dari sistem terbuka.
Terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungan. Hambatan yang memungkinkan terjadinya pertukaran benda disebut permeabel. Lautan ini adalah contoh sistem terbuka.
Faktanya, sistem tidak dapat atau dapat sepenuhnya diisolasi dari lingkungan, karena meskipun hanya gaya gravitasi yang diterima sedikit, beberapa jenis pencampuran harus terjadi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
Keadaan Termodinamika
Ketika sistem dalam keadaan seimbang di bawah kondisi yang ditentukan, itu disebut keadaan tetap (atau keadaan sistem).
Untuk beberapa situasi termodinamika, banyak sifat sistem yang ditentukan. Atribut yang tidak ada hubungannya dengan jalur di mana sistem membentuk suatu keadaan disebut fungsi keadaan sistem. Kemudian, sisa bagian ini hanya mempertimbangkan atribut, yaitu fungsi status.
Kemudian jumlah karakteristik minimum harus ditentukan untuk menggambarkan situasi atau keadaan sistem tertentu, yang ditentukan oleh hukum fase Gibbs. Biasanya, atribut sistem yang akan ditangani orang ini lebih besar dari minimum ini.
Pengembangan hubungan antar atribut dimungkinkan dalam keadaan yang berbeda. Persamaan keadaan adalah contoh dari hubungan ini.
Demikianlan penjelasan tentang Termodinamikas : Pengertian, Konsep dan Rumus semoga artikel di atas bermanfaat.